아연 집게
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
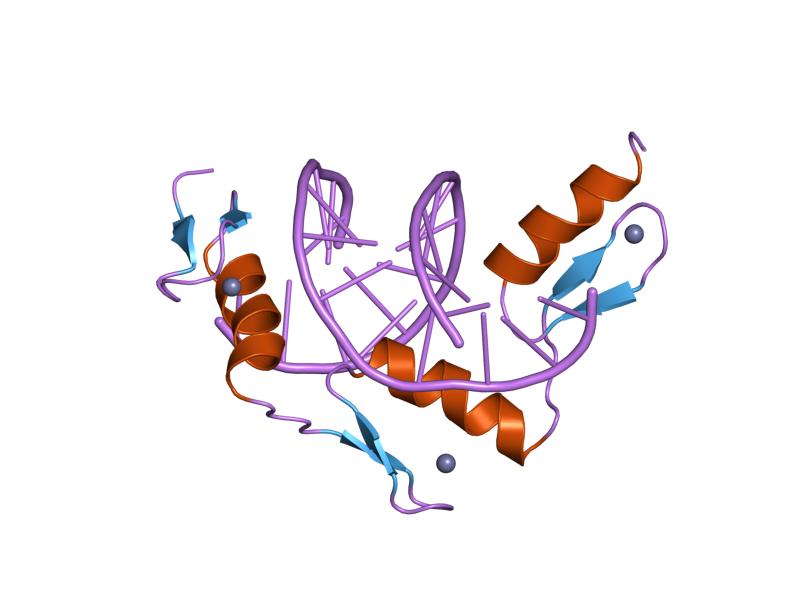
아연 집게는 특정 RNA 서열의 전사 연구에서 처음 발견된 DNA 결합 모티프이다. 아연 이온을 포함하는 손가락 모양의 구조로, DNA 및 RNA, 단백질, 지질 등 다양한 분자와 결합할 수 있다. 아연 집게는 Cys2His2, Gag-knuckle, Treble-clef, 아연 리본, Zn2/Cys6 등 다양한 구조로 분류되며, 유전자 전사, 번역, 세포 골격 조직 등 다양한 생물학적 과정에 관여한다. 아연 집게의 모듈식 특성으로 특정 DNA 서열을 표적으로 하는 단백질 설계에 활용되며, 아연 집게 핵산 분해 효소(ZFN) 및 아연 집게 전사 인자(ZFTF) 등 유전자 편집 및 조절 기술에 응용된다.
더 읽어볼만한 페이지
- 단백질 구조 모티프 - 베타 병풍
베타 병풍은 폴리펩타이드 사슬 간 수소 결합으로 형성된 단백질 2차 구조로, 사슬 방향에 따라 평행 또는 역평행 구조로 나뉘며 다양한 구조적 모티프를 형성하고 구상 및 섬유상 단백질, 아밀로이드와 관련된다. - 단백질 구조 모티프 - 삼중나선
삼중나선은 DNA, RNA, 콜라겐 등에서 발견되는 세 개의 나선이 축을 공유하는 분자 구조로, 유전자 발현 조절, RNA 안정성, 세포 외 기질 구조 유지 등의 기능과 관련되며, 최근에는 딥 러닝 기반 예측 도구가 개발되어 생명공학 연구에 활용된다. - DNA 결합 물질 - 네오마이신
네오마이신은 셀먼 왁스먼과 허버트 레체발리에가 ''Streptomyces fradiae''에서 발견한 아미노글리코사이드 계열 항생 물질로, 네오스포린 국소 제제, 경구 투여를 통한 간성 뇌증 및 고콜레스테롤혈증 예방에 사용되며, 그람 음성균과 양성균에 효과가 있지만 신독성 및 알레르기 반응의 부작용과 네오마이신 내성 유전자의 선택 표지 활용에 주의해야 한다. - DNA 결합 물질 - 단일 가닥 DNA 결합 단백질
단일 가닥 DNA 결합 단백질(SSB)은 세균에서 DNA 복제, 복구 및 재조합과 같은 DNA 대사 과정을 유지하는 데 중요한 역할을 하며, 단일 가닥 DNA를 안정화시켜 DNA 복제, 수선 및 재조합을 용이하게 하는 단백질이다. - 단백질 도메인 - CD4
CD4는 보조 T 세포 표면에서 T 세포 수용체의 공동수용체로 작용하여 항원제시세포와 상호작용을 돕고 T 세포 활성화 신호를 증폭시키는 면역계의 당단백질이며, HIV의 숙주 세포 침투 수용체로 작용하여 HIV 감염 및 AIDS 발병에 중요한 역할을 한다. - 단백질 도메인 - 인터루킨 4
인터루킨 4(IL-4)는 B 세포와 T 세포를 자극하고 형질세포로 분화시키는 사이토카인으로, 체액성 및 후천성 면역 조절, IgE 및 IgG4 생산 유도, MHC 클래스 II 생산 촉진과 함께 알레르기 질환, 기관지 천식, 만성 염증, 상처 치유, 암 발병 및 진행, HIV 질환 등 다양한 질병에 관여하는 것으로 알려져 있다.
2. 역사
아프리카 발톱 개구리( ''Xenopus laevis'')의 전사 연구에서 에런 클럭 연구실에서 아연 집게가 처음으로 확인되었다. 특정 RNA 서열의 전사 연구는 작은 전사 인자(전사 인자 IIIA; TFIIIA)의 결합 강도가 아연을 조정하는 손가락 모양의 구조 때문임을 밝혀냈다.[5] TFIIIA의 아미노산 서열 분석 결과, 두 개의 불변 시스테인과 히스티딘 잔기를 포함하는 30개의 아미노산으로 이루어진 9개의 직렬 서열이 나타났다. 확장 X선 흡수 미세 구조는 아연 리간드의 정체를 확인했다: 두 개의 시스테인과 두 개의 히스티딘.[6] 아연에 의해 이러한 리간드가 조정되어 형성된 DNA 결합 루프는 손가락과 유사하다고 여겨져 이 이름이 붙었다.[1] 이후 곧 1986년 슈 팀에 의해 ''초파리''에서 크루펠 인자가 발견되었다.[4]
아연 집게 도메인(Znf)은 표적 분자와 직렬 접촉하는 집게 모양의 돌출부가 여러 개 들어 있는 비교적 작은 단백질 모티프다. 이러한 도메인들 중 일부는 아연과 결합하지만, 많은 도메인들은 철과 같은 다른 금속을 결합하거나 전혀 결합하지 않는다. 예를 들어, 몇몇 족들은 염다리를 형성하여 집게와 같은 주름을 안정시킨다.[53][54][55][56][57] 이들은 처음에 아프리카발톱개구리의 전사 인자 TFIIIA에서 DNA 결합 모티브로 확인되었으나, 현재는 DNA, RNA, 단백질, 지질들을 결합하는 것으로 인식되고 있다.[58] 이들의 결합 특성은 집게 영역의 아미노산 순서와 집게 사이의 연결점, 그리고 고차 구조와 집게의 수에 따라 달라진다. 아연 집게 도메인은 집게가 서로 다른 결합 특성을 가질 수 있는 클러스터에서 흔히 발견된다. 아연 집게 모티브는 몇 가지 관련이 없는 단백질 수퍼 패밀리에서 발생하며, 순서와 구조가 모두 다르다. 이들은 같은 부류의 구성원들(예 : 일부 결합 DNA, 다른 단백질) 사이의 결합에서 상당한 다기능성을 보여 아연 집게 모티브가 전문화된 기능을 발전시킨 안정적임을 시사한다. 예를 들어 아연 집게 단백질의 기능은 유전자 전사, 번역, 전령 RNA 트래피킹, 세포 골격 조직, 상피 발달, 세포 부착, 단백질 접힘, 크로마틴 리모델링, 아연 감지 등에서 사용된다. 아연 결합 모티브는 안정된 구조로, 표적을 묶을 때 순응적인 변화를 거의 겪지 않는다.
아연 집게라는 용어는 처음에는 아프리카발톱개구리에서 발견된 DNA 결합 모티프를 설명하는 데에만 사용되었지만, 현재는 아연 이온의 배위에 의해 관련된 구조를 통칭하는 데 사용된다. 일반적으로 아연 집게는 시스테인과 히스티딘 잔기의 조합으로 아연 이온을 배위 결합한다.
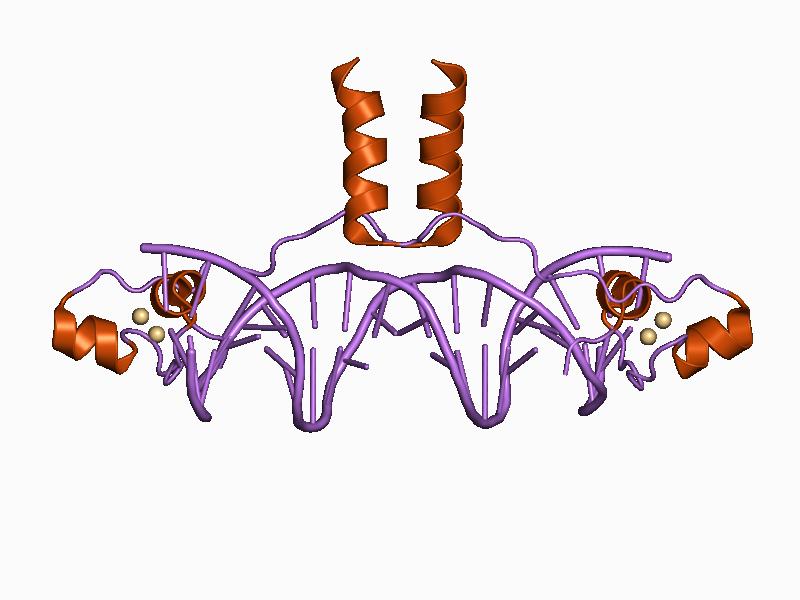
1991년과 1993년에 해결된 아연 집게-DNA 복합체의 결정 구조는 아연 집게가 DNA와 상호 작용하는 전형적인 패턴을 보여주었다.[29][9] 아연 집게의 결합은 이중 나선의 2배 대칭을 통해 DNA에 결합하는 다른 많은 DNA 결합 단백질과 구별되는 것으로 밝혀졌으며, 대신 아연 집게는 다양한 길이의 핵산 서열에 결합하기 위해 직렬로 선형으로 연결되어 있다.[6] 아연 집게는 종종 GC 박스로 알려진 DNA 서열에 결합한다.[10] 1994년에는 인공적으로 구성된 3중 집게 단백질이 생쥐 세포주에서 종양 유전자의 발현을 차단할 수 있음이 밝혀졌다. 이후 치료적 중요성을 지닌 다양한 다른 이펙터 도메인에 융합된 아연 집게가 구성되었다.[6]
그 중요성으로 인해 "아연 집게 모티프"는 2024년 노벨 화학상의 과학적 배경에 인용되었다. (계산 단백질 설계 및 단백질 구조 예측으로 데이비드 베이커, 데미스 하사비스, 존 M. 점퍼에게 수여).[11]
3. 도메인
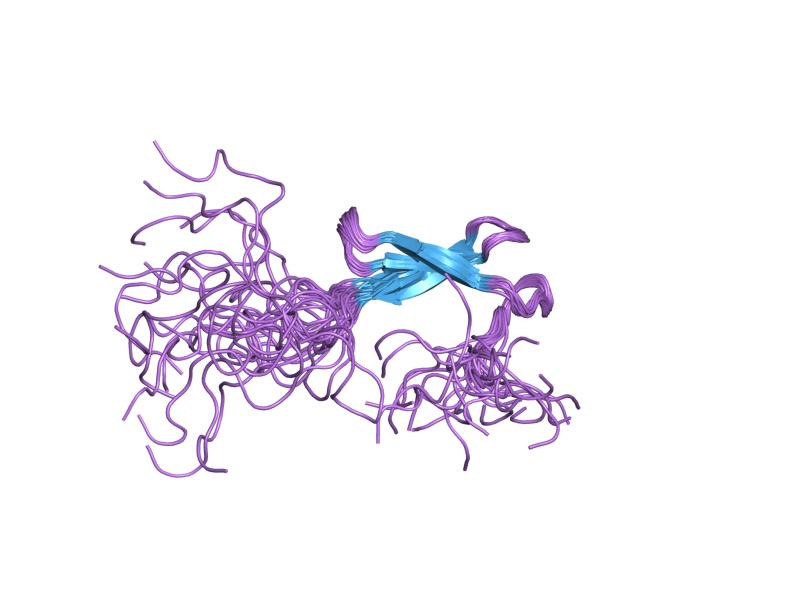
처음에는 아연 집게라는 용어가 아프리카발톱개구리에서 발견된 DNA 결합 모티브를 설명하는 데만 사용되었지만, 현재는 아연 이온의 조정에 의해 관련된 어떤 수의 구조물을 가리키는 데 사용되고 있다. 일반적으로 아연 집게는 아연 이온을 시스테인과 히스티딘 잔기의 조합으로 배위 결합한다. 원래 이러한 잔기의 수와 순서는 다른 종류의 아연 집게(예 : Cys2His2, Cys4, Cys6)를 분류하는 데 사용되었다. 최근에는 아연 집게 단백질을 대신 분류하는 더 체계적인 방법이 사용되고 있다. 이 방법은 아연 집게 단백질을 접힌 영역의 단백질 골격의 전체적인 모양을 바탕으로 접힘 그룹으로 분류한다. 가장 흔한 아연 집게의 접힘 그룹은 Cys2His2, treble clef, 아연 리본이다.
다음 표는[59] 아연 집게의 다양한 구조와 주요 특징을 보여준다.
4. 분류
과거에는 이러한 잔기의 수와 순서에 따라 아연 집게를 Cys2His2, Cys4, Cys6 등으로 분류했다. 최근에는 아연 집게 단백질을 접힌 영역의 단백질 골격의 전체적인 모양을 바탕으로 "접힘 그룹"으로 분류하는 보다 체계적인 방법이 사용되고 있다. 가장 흔한 아연 집게의 접힘 그룹은 Cys2His2 유사 ("클래식 아연 집게"), 음자리표, 아연 리본이다.
아연 집게의 다양한 구조와 주요 특징은 아래 표와 같다.[59]
4. 1. Cys2His2
Cys2His2 유사 접힘 그룹(C2H2)은 현재까지 가장 잘 알려진 아연 집게 계층이며 포유류에서 전사인자로 나타난다. 이러한 도메인은 간단한 ββα 접힘을 채택하고 아미노산 서열 모티프를 갖는다.[60]
: X2 - Cys - X2,4 - Cys - X12 - His - X3,4,5 - His
이러한 종류의 아연 집게는 RNA 결합 단백질 및 단백질-단백질 상호 작용을 매개하는 것과 같은 다양한 기능을 가질 수 있지만, Zif268(Egr1)과 같은 서열 특이적 DNA 결합 단백질에서의 역할로 가장 잘 알려져 있다. 이러한 단백질에서 개별 아연 집게 도메인은 전형적으로 단백질의 DNA 결합 도메인을 포함하는 2~3개, 또는 그 이상의 집게와 직렬 반복으로 발생한다. 이러한 직렬 배열은 DNA의 Major Groove에 결합 할 수 있으며 일반적으로 3bp 간격으로 떨어져 있다. 각 도메인의 알파 나선(인식 나선이라고도 함)은 DNA 염기에 서열 특이적 접촉을 할 수 있다. 단일 인식 나선으로부터의 잔기는 4개 이상의 염기와 접촉하여 인접한 아연 집게와의 접촉 패턴의 중첩 패턴을 생성 할 수 있다.
가장 잘 연구된 C2H2 클래스의 아연 핑거에서는 β 시트의 두 개의 시스테인 잔기와 α 헬릭스의 두 개의 히스티딘 잔기가 아연 이온과의 결합에 관여한다.
4. 2. Gag-knuckle
이 접힘 그룹은 회전(아연 너클)과 짧은 나선 또는 루프로 연결된 두 개의 짧은 베타 가닥으로 정의되며, 나선의 대부분과 베타 헤어핀 구조가 잘린 것이 고전적인 Cys2His2과 유사하다.
HIV 및 다른 레트로바이러스로부터의 레트로바이러스 뉴클레오캡시드(NC) 단백질은 이러한 모티프를 갖는 단백질의 예이다. HIV NC 단백질의 Gag-knuckle은 아연 집게 억제제로 알려진 약물 종류의 표적이다.
4. 3. Treble-clef
Treble-clef 모티프는 N 말단의 베타 헤어핀 구조와 C 말단의 알파 나선 구조로 구성되며, 각 구조는 아연 결합에 두 개의 리간드를 제공한다. N 말단 베타 헤어핀 구조와 C 말단 알파 나선 구조 사이에는 길이와 형태가 다른 루프와 두 번째 베타 헤어핀 구조가 존재한다. 이러한 집게는 종종 서열이나 기능적 유사성을 공유하지 않는 다양한 단백질 그룹에서 발견된다. Treble-clef 아연 집게를 함유한 가장 잘 알려진 단백질은 핵 수용체이다.
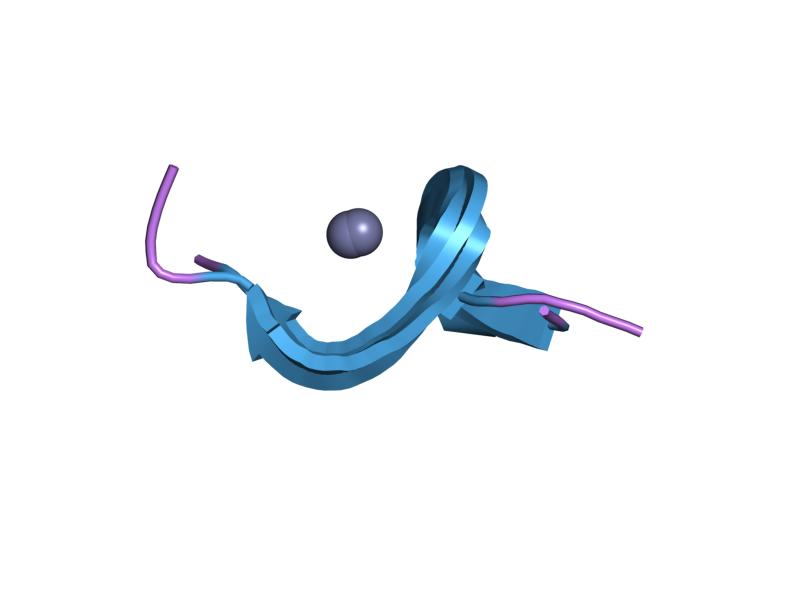
4. 4. 아연 리본
아연 리본 폴드는 구조적으로 유사한 아연 결합 하위 부위 두 개를 형성하는 두 개의 베타 헤어핀으로 특징지어진다.[1]
4. 5. Zn2/Cys6
이 부류의 표준 구성원은 2개의 아연 이온이 6개의 시스테인 잔기에 의해 결합된 이핵성 아연 클러스터를 함유한다. 이 아연 집게는 효모 Gal4 단백질을 포함한 여러 전사인자에서 찾을 수 있다.4. 6. 기타
아연 집게라는 용어는 원래 개구리에서 발견된 DNA 결합 모티프를 설명하는 데에만 사용되었지만, 현재는 아연 이온의 배위에 의해 관련되어 있는 구조를 통칭하는 데 사용된다. 일반적으로 아연 집게는 시스테인과 히스티딘 잔기의 조합으로 아연 이온을 배위한다. 원래, 이러한 잔기의 수와 순서는 다양한 유형의 아연 집게(예: Cys2His2, Cys4, Cys6)를 분류하는 데 사용되었다. 최근에는 아연 집게 단백질을 분류하는 데 보다 체계적인 방법이 사용되고 있다. 이 방법은 접힌 도메인에서 단백질 백본의 전체적인 모양을 기준으로 아연 집게 단백질을 "폴드 그룹"으로 분류한다. 아연 집게의 가장 일반적인 "폴드 그룹"은 Cys2His2-유사( "클래식 아연 집게"), 음자리표 및 아연 리본이다.다음 표는 다양한 구조와 주요 특징을 보여준다.
아연 집게 항바이러스 단백질(ZAP영어)은 CpG 부위에 결합한다. 포유류에서 항바이러스 방어에 사용된다.[19][20]
5. 구조
아연 집게(Znf) 단백질 도메인은 표적 분자와 직렬 접촉을 하는 여러 개의 손가락 모양 돌출부를 포함하는 비교적 작은 단백질 모티프이다. 이러한 도메인 중 일부는 분자 결합을 통해 아연에 결합하지만, 많은 도메인은 철과 같은 다른 금속이나 금속에 전혀 결합하지 않는다. 예를 들어, 일부 가족 구성원은 손가락 모양의 단백질 접힘을 안정시키기 위해 염 다리를 형성한다.[12][13][14][15][16]
각각의 아연 집게 구조는 잘 보존되어 있으며, 약 30개의 아미노산 잔기로 구성되어 있고, ββα 폴드 구조로 아연 이온을 갖는다. α-나선은 C 말단에, β-시트는 N 말단에 위치한다. 보존 서열은
6. 결합
아연 집게 도메인(Znf)은 표적 분자와 직렬 접촉하는 집게 모양의 돌출부가 여러 개 들어 있는 비교적 작은 단백질 모티브이다. 이러한 도메인들 중 일부는 아연과 결합하지만, 많은 도메인들은 철과 같은 다른 금속을 결합하거나 전혀 결합하지 않는다. 예를 들어, 몇몇 족들은 염다리를 형성하여 집게와 같은 주름을 안정시킨다.[53][54][55][56][57] 이들은 처음에 아프리카발톱개구리의 전사 인자 TFIIIA에서 DNA 결합 모티브로 확인되었으나, 현재는 DNA, RNA, 단백질, 지질들을 결합하는 것으로 인식되고 있다. 이들의 결합 특성은 집게 영역의 아미노산 서열과 집게 사이의 연결점, 그리고 고차 구조와 집게의 수에 따라 달라진다. 아연 집게 도메인은 집게가 서로 다른 결합 특성을 가질 수 있는 클러스터에서 흔히 발견된다.
7. 단백질
아연 집게 도메인(Znf)은 표적 분자와 직렬 접촉하는 집게 모양의 돌출부가 여러 개 있는 비교적 작은 단백질 모티프이다. 이러한 도메인들 중 일부는 분자 결합을 통해 아연과 결합하지만, 많은 도메인은 철과 같은 다른 금속이나 금속에 전혀 결합하지 않는다. 예를 들어, 일부는 염다리를 형성하여 집게와 같은 주름을 안정시킨다.[53][54][55][56][57]
아연 집게는 아프리카발톱개구리(''Xenopus laevis'')의 전사 인자 TFIIIA에서 DNA 결합 모티브로 처음 확인되었으나, 현재는 DNA, RNA, 단백질, 지질들을 결합하는 것으로 알려져 있다.[12][13][14][15][16] 이들의 결합 특성은 집게 영역의 아미노산 순서와 집게 사이의 연결점, 그리고 고차 구조와 집게의 수에 따라 달라진다. 아연 집게 도메인은 집게가 서로 다른 결합 특성을 가질 수 있는 클러스터에서 흔히 발견된다.
아연 집게 모티브는 몇 가지 관련이 없는 단백질 수퍼 패밀리에서 발생하며, 순서와 구조가 모두 다르다. 이들은 같은 부류의 구성원들(예: 일부는 DNA에 결합, 다른 것은 단백질에 결합) 사이의 결합에서 상당한 다기능성을 보여 아연 집게 모티브가 전문화된 기능을 발전시킨 안정적인 구조임을 시사한다. 예를 들어 아연 집게 단백질의 기능은 유전자 전사, 번역, 전령 RNA 트래피킹, 세포 골격 조직, 상피 발달, 세포 부착, 단백질 접힘, 염색질 리모델링, 아연 감지 등에서 사용된다.[58] 아연 결합 모티브는 안정된 구조로, 표적을 묶을 때 순응적인 변화를 거의 겪지 않는다.
Zif268 등과 같은 많은 전사 인자 및 조절 단백질은 아연 집게를 가지고 있다. 이러한 단백질에서는 일반적으로 DNA 이중 나선의 주구(主溝)와 아연 집게의 α 나선이 상호 작용한다. 초기 신경의 발달을 조절하는 뉴런 특이적 전사 인자 역시 아연 집게 구조를 갖는다.
8. 응용
단백질 공학 기법을 사용하여 아연 집게의 DNA 결합 특이성을 변경하여 원하는 게놈 DNA 염기서열을 표적으로 삼을 수 있다.[61] 이렇게 조작된 아연 집게는 특정 유전자의 전사를 조절하거나, 원하는 게놈 위치에 DNA를 절단 또는 수정하는 데 활용될 수 있다. 대표적인 응용 분야로는 아연 집게 전사 인자와 아연 집게 뉴클레아제가 있으며, 그 외에도 다양한 응용법이 개발되고 있다.
아연 집게는 아프리카 발톱 개구리(''Xenopus laevis'')의 전사 연구 과정에서 에런 클럭 연구실에서 처음 발견되었다.[5] 이후 초파리의 크루펠 인자에서도 발견되었으며,[4] 다양한 생물체의 단백질에서 아연 이온이 폴리펩타이드 안정화에 중요한 역할을 한다는 사실이 밝혀졌다.[7][8]
아연 집게는 DNA 이중 나선의 2배 대칭을 통해 결합하는 다른 DNA 결합 단백질과 달리, 선형으로 연결되어 다양한 길이의 핵산 서열에 결합한다.[6] 이러한 모듈식 특성 덕분에 DNA 및 RNA 서열의 많은 조합을 높은 친화도와 특이성으로 결합할 수 있어, 특정 DNA 서열을 표적으로 하는 단백질 설계에 이상적이다. 1994년에는 인공적으로 구성된 3중 집게 단백질이 생쥐 세포주에서 종양 유전자의 발현을 차단할 수 있음이 밝혀졌다.[6]
"아연 집게 모티프"는 2024년 노벨 화학상의 과학적 배경에 인용되기도 했다.[11]
8. 1. 아연 집게 핵산 분해 효소 (Zinc Finger Nuclease, ZFN)
아연 집게 핵산 분해 효소(ZFN)는 DNA 절단 도메인(주로 FokI의 절단 도메인)에 융합된 아연 집게 단백질로 구성된 인공 제한 효소이다. 다양한 단백질 공학 기법을 통해 아연 집게의 DNA 결합 특이성을 변경하여, 특정 DNA 염기서열을 표적으로 할 수 있다.[21]이러한 특징을 이용하여 아연 집게 핵산 분해 효소는 노랑초파리, 예쁜꼬마선충, 제브라 다니오[63], 담배, 옥수수[64], 얼룩말, 다양한 종류의 포유류 세포[65], 쥐[66] 등 고등 유기체의 게놈을 조작하는 데 활용된다.[26]
원하는 게놈 위치에 이중 가닥 절단을 유도하면, 비상동성 DNA 수선 경로의 오류 발생 가능성이 높은 성질을 이용하여 유전자의 암호화 서열에 프레임 이동 돌연변이를 일으킬 수 있다. 또한, 상동성 DNA 공여자 서열을 사용하면, 상동성 지정 수선 경로를 통해 유전자좌를 원하는 서열로 바꿀 수 있다.
현재 진행 중인 임상 실험에서는 CD4+ 인간 T 세포에서 CCR5 유전자를 교란시키는 아연 집게 핵산 분해 효소를 후천성면역결핍증후군(AIDS)의 잠재적 치료제로 평가하고 있다.[67]
8. 2. 아연 집게 전사 인자 (Zinc Finger Transcription Factor, ZFTF)
다양한 단백질 공학 기법을 사용하여 아연 집게의 DNA 결합 특이성을 변경할 수 있으며, 이렇게 조작된 아연 집게를 직렬로 반복시켜 원하는 게놈 DNA 염기서열을 표적으로 삼을 수 있다.[61] 전사 활성자나 억제자와 같은 다른 단백질 영역을 주어진 유전자의 프로모터 근처에 결합하는 일련의 공학적 아연 집게에 결합하면 해당 유전자의 전사를 바꿀 수 있다.[22] DNA를 절단하거나 변형하는 아연 집게 배열과 단백질 도메인 사이의 융합은 원하는 게놈 위치의 활동들을 목표로 하는 데 사용될 수 있다.[22]공학적 아연 집게 배열의 가장 일반적인 응용법은 아연 집게 전사인자와 아연 집게 뉴클레아제이지만, 다른 응용법도 개발되었다. 대표적인 공학적 아연 집게 배열은 3개에서 6개의 개별 아연 집게 모티프를 가지고 있으며, 9개에서 18개의 염기쌍 길이의 결합 대상 부분을 가지고 있다. 6개의 아연 집게 모티프가 있는 배열은 포유류 게놈에서 특이할 가능성이 충분히 있는 대상을 묶기 때문에 특히 매력적이다.[62]
대부분의 공학적 아연 집게 배열은 쥐 전사 인자 Zif268의 아연 집게 도메인을 기반으로 하지만, 일부는 인간 전사인자 SP1을 기반으로 하는 아연 집게 배열을 사용하기도 한다. Zif268은 총 9bp 서열에 높은 친화도로 결합하는 3개의 개별 아연 집게 모티프를 가지고 있다.[28] 1991년에 DNA에 결합된 이 단백질의 구조가 발견되었고,[69] 이는 공학적 아연 집게 배열에 대한 많은 연구를 촉발시켰다. 1994년과 1995년에 여러 그룹이 파지 디스플레이를 사용하여 Zif268의 단일 아연 집게의 특이성을 변경했다.[70][71][72][73]
현재 공학적 아연 집게 배열을 생성하는 데 사용되는 두 가지 주요 방법은 모듈식 조립 및 세균 선택 시스템이며, 어떤 방법이 대부분의 용도에 가장 적합한지에 대한 논란이 있다.[74][75] 새로운 아연 집게 배열을 생성하는 가장 간단한 방법은 알려진 특이성을 가진 작은 아연 집게 "모듈"을 결합하는 것이다. 가장 일반적인 모듈식 조립 과정은 각각 3염기쌍 DNA 서열을 인식할 수 있는 개별 아연 집게를 결합하여 9염기쌍에서 18염기쌍 길이의 표적 부위를 인식하는 3손가락, 4손가락, 5손가락 또는 6손가락 배열을 생성하는 것이다.
Zif268 등과 같은 많은 전사 인자 및 조절 단백질이 아연 집게를 가지고 있다. 이러한 단백질에서는 일반적으로 DNA 이중 나선의 주홈(主溝)과 아연 집게의 α 나선이 상호 작용한다. 초기 신경의 발달을 조절하는 뉴런 특이적 전사 인자 역시 아연 집게 구조를 갖는다.
8. 3. 기타 응용
다양한 단백질 공학 기법을 사용하여 아연 집게의 DNA 결합 특성을 변경할 수 있다.[61] 이렇게 공학적으로 처리된 아연 집게를 직렬로 반복하여 원하는 게놈 DNA 염기서열을 대상으로 할 수 있다. 전사 활성자나 억제자와 같은 두 번째 단백질 영역을 주어진 유전자의 촉진유전자 근처에 결합하는 일련의 공학적 아연 집게에 결합하면 그 유전자의 전사를 바꿀 수 있다. DNA를 갈라놓거나 수정하는 아연 집게 배열과 단백질 도메인 사이의 융합은 원하는 게놈 위치의 활동들을 목표로 하는 데 사용될 수 있다. 공학적 아연 집게 배열의 가장 일반적인 응용법은 아연 집게 전사인자와 아연 집게 핵산 분해 효소이지만 다른 응용법도 개발되었다. 대표적인 공학적 아연 집게 배열은 3개에서 6개의 개별 아연 집게 모티브를 가지고 있으며 길이가 9개에서 18개의 염기쌍에 이르는 결합 대상 부분을 가지고 있다. 6개의 아연 집게 모티브가 있는 배열은 포유류 게놈에서 특이할 가능성이 충분히 있는 대상을 묶기 때문에 특히 매력적이다.[62]참조
[1]
논문
Zinc fingers: a novel protein fold for nucleic acid recognition
[2]
논문
Xenopus transcription factor A requires zinc for binding to the 5 S RNA gene
1983-12
[3]
논문
Zinc fingers and other metal-binding domains. Elements for interactions between macromolecules
1990-04
[4]
논문
The Arms Race Between KRAB-Zinc Finger Proteins and Endogenous Retroelements and Its Impact on Mammals
Annual Reviews (publisher)
2019-12
[5]
논문
Repetitive zinc-binding domains in the protein transcription factor IIIA from Xenopus oocytes
1985-06
[6]
논문
The discovery of zinc fingers and their applications in gene regulation and genome manipulation
[7]
논문
Zinc ions promote Alzheimer Abeta aggregation via population shift of polymorphic states
2010-05
[8]
논문
Metal-dependent folding and stability of nuclear hormone receptor DNA-binding domains
2002-05
[9]
논문
The crystal structure of a two zinc-finger peptide reveals an extension to the rules for zinc-finger/DNA recognition
1993-12
[10]
논문
Importance of a flanking AT-rich region in target site recognition by the GC box-binding zinc finger protein MIG1
1994-03
[11]
문서
https://www.nobelpri[...]
[12]
논문
Zinc finger peptides for the regulation of gene expression
1999-10
[13]
논문
Multiple modes of RNA recognition by zinc finger proteins
https://zenodo.org/r[...]
2005-06
[14]
논문
Zinc finger proteins: getting a grip on RNA
2005-02
[15]
논문
Sticky fingers: zinc-fingers as protein-recognition motifs
2007-02
[16]
논문
Zinc fingers--folds for many occasions
2002-12
[17]
논문
Zinc finger proteins: new insights into structural and functional diversity
2001-02
[18]
논문
Structural classification of zinc fingers: survey and summary
2003-01
[19]
논문
Extreme genomic CpG deficiency in SARS-CoV-2 and evasion of host antiviral defense
https://academic.oup[...]
Academic Press
2020-04-14
[20]
뉴스
Evidence of Stray Dogs as Possible Origin of COVID-19 Pandemic
https://scitechdaily[...]
SciTechDaily
2020-04-14
[21]
논문
Design and selection of novel Cys2His2 zinc finger proteins
[22]
논문
Drug discovery with engineered zinc-finger proteins
2003-05
[23]
논문
Design of polydactyl zinc-finger proteins for unique addressing within complex genomes
1997-05
[24]
논문
'[3H]MK801 binding to the N-methyl-D-aspartate receptor reveals drug interactions with the zinc and magnesium binding sites'
1988-12
[25]
논문
Progress and prospects: zinc-finger nucleases as gene therapy agents
2008-11
[26]
논문
Knockout rats via embryo microinjection of zinc-finger nucleases
2009-07
[27]
웹사이트
Autologous T-Cells Genetically Modified at the CCR5 Gene by Zinc Finger Nucleases SB-728 for HIV
http://clinicaltrial[...]
ClinicalTrials.gov
[28]
논문
DNA binding site of the growth factor-inducible protein Zif268
1989-11
[29]
논문
Zinc finger-DNA recognition: crystal structure of a Zif268-DNA complex at 2.1 A
1991-05
[30]
논문
Zinc finger phage: affinity selection of fingers with new DNA-binding specificities
1994-02
[31]
논문
In vitro selection of zinc fingers with altered DNA-binding specificity
1994-05
[32]
논문
Toward a code for the interactions of zinc fingers with DNA: selection of randomized fingers displayed on phage
1994-11
[33]
논문
Building zinc fingers by selection: toward a therapeutic application
1995-01
[34]
논문
Genome editing with modularly assembled zinc-finger nucleases
2010-02
[35]
논문
Reply to "Genome editing with modularly assembled zinc-finger nucleases"
2010-02
[36]
논문
Precise genome modification in the crop species Zea mays using zinc-finger nucleases
2009-05
[37]
논문
Toward controlling gene expression at will: selection and design of zinc finger domains recognizing each of the 5'-GNN-3' DNA target sequences
1999-03
[38]
논문
Development of zinc finger domains for recognition of the 5'-CNN-3' family DNA sequences and their use in the construction of artificial transcription factors
2005-10
[39]
논문
Development of zinc finger domains for recognition of the 5'-ANN-3' family of DNA sequences and their use in the construction of artificial transcription factors
2001-08
[40]
논문
Human zinc fingers as building blocks in the construction of artificial transcription factors
2003-03
[41]
논문
Unexpected failure rates for modular assembly of engineered zinc fingers
2008-05
[42]
논문
Targeted genome editing in human cells with zinc finger nucleases constructed via modular assembly
2009-07
[43]
논문
Selection-free zinc-finger-nuclease engineering by context-dependent assembly (CoDA)
2011-01
[44]
논문
A general strategy for selecting high-affinity zinc finger proteins for diverse DNA target sites
1997-01
[45]
논문
Rapid "open-source" engineering of customized zinc-finger nucleases for highly efficient gene modification
2008-07
[46]
논문
MYST family histone acetyltransferases in the protozoan parasite Toxoplasma gondii
2005-12
[47]
논문
The histone H4 acetyltransferase MOF uses a C2HC zinc finger for substrate recognition
2001-02
[48]
논문
Myelin transcription factor 1 (Myt1) of the oligodendrocyte lineage, along with a closely related CCHC zinc finger, is expressed in developing neurons in the mammalian central nervous system
https://zenodo.org/r[...]
1997-10
[49]
논문
ST18 is a breast cancer tumor suppressor gene at human chromosome 8q11.2
2004-12
[50]
저널
Zinc fingers: a novel protein fold for nucleic acid recognition
1987
[51]
저널
Xenopus transcription factor A requires zinc for binding to the 5 S RNA gene
https://archive.org/[...]
1983-12
[52]
저널
Zinc fingers and other metal-binding domains. Elements for interactions between macromolecules
1990-04
[53]
저널
Zinc finger peptides for the regulation of gene expression
1999-10
[54]
저널
Multiple modes of RNA recognition by zinc finger proteins
https://zenodo.org/r[...]
2005-06
[55]
저널
Zinc finger proteins: getting a grip on RNA
2005-02
[56]
저널
Sticky fingers: zinc-fingers as protein-recognition motifs
2007-02
[57]
저널
Zinc fingers--folds for many occasions
2002-12
[58]
저널
Zinc finger proteins: new insights into structural and functional diversity
2001-02
[59]
저널
Structural classification of zinc fingers: survey and summary
2003-01
[60]
저널
Design and selection of novel Cys2His2 zinc finger proteins
2001
[61]
저널
Design and selection of novel Cys2His2 zinc finger proteins
2001
[62]
저널
Design of polydactyl zinc-finger proteins for unique addressing within complex genomes
1997-05
[63]
저널
"[3H]MK801 binding to the N-methyl-D-aspartate receptor reveals drug interactions with the zinc and magnesium binding sites"
1988-12
[64]
저널
Precise genome modification in the crop species Zea mays using zinc-finger nucleases
2009-05
[65]
저널
Progress and prospects: zinc-finger nucleases as gene therapy agents
2008-11
[66]
저널
Knockout rats via embryo microinjection of zinc-finger nucleases
2009-07
[67]
웹인용
Autologous T-Cells Genetically Modified at the CCR5 Gene by Zinc Finger Nucleases SB-728 for HIV
http://clinicaltrial[...]
ClinicalTrials.gov
2009
[68]
저널
DNA binding site of the growth factor-inducible protein Zif268
1989-11
[69]
저널
Zinc finger-DNA recognition: crystal structure of a Zif268-DNA complex at 2.1 A
1991-05
[70]
저널
Zinc finger phage: affinity selection of fingers with new DNA-binding specificities
1994-02
[71]
저널
In vitro selection of zinc fingers with altered DNA-binding specificity
1994-05
[72]
저널
Toward a code for the interactions of zinc fingers with DNA: selection of randomized fingers displayed on phage
1994-11
[73]
저널
Building zinc fingers by selection: toward a therapeutic application
1995-01
[74]
저널
Genome editing with modularly assembled zinc-finger nucleases
2010-02
[75]
저널
Reply to "Genome editing with modularly assembled zinc-finger nucleases"
2010-02
[76]
저널
MYST family histone acetyltransferases in the protozoan parasite Toxoplasma gondii
2005-12
[77]
저널
The histone H4 acetyltransferase MOF uses a C2HC zinc finger for substrate recognition
2001-02
[78]
저널
Myelin transcription factor 1 (Myt1) of the oligodendrocyte lineage, along with a closely related CCHC zinc finger, is expressed in developing neurons in the mammalian central nervous system
https://zenodo.org/r[...]
1997-10
[79]
저널
ST18 is a breast cancer tumor suppressor gene at human chromosome 8q11.2
2004-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com